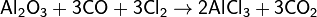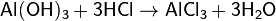

Глоссарий. Хлорид алюминия.
Хлорид алюминия- соль алюминия и соляной кислоты. Химическая формула — AlCl3.
При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O при 25 °C); вследствие гидролиза дымит во влажном воздухе, выделяя HCl. Из водных растворов выпадает кристаллогидрат AlCl3· 6H2O — желтовато-белые расплывающиеся кристаллы. Хорошо растворим во многих органических соединениях (в этаноле — 100 г в 100 г спирта при 25 °C, в ацетоне, дихлорэтане, этиленгликоле, нитробензоле, тетрахлоруглероде и др.); однако практически не растворяется в бензоле и толуоле.
Важнейший способ получения хлорида алюминия в промышленности — действие смеси Cl2 и CO на обезвоженный каолин или боксит в шахтных печах:
При температуре в 900 °C трихлорид бора и фосфид алюминия дают на выходе фосфид бора и хлорид алюминия:
Также есть и другие способы получения хлорида алюминия:
-

- Применение: Безводный хлорид алюминия образует продукты присоединения со многими неорганическими (например, NH3, H2S, SO2) и органическими (хлорангидриды кислот, эфиры и др.) веществами, с чем связано важнейшее техническое применение AlCl3 как катализатора при переработке нефти и при органических синтезах (например, реакция Фриделя — Крафтса). Гексагидрат и его растворы используются при очистке сточных вод, обработке древесины, производстве антиперспирантов и пр. Мировое произ-во алюминия хлорида более 140 тыс. т/год (1980).